호르몬 수용체 약양성 유방암과 삼중음성 유방암의 치료 예후
Treatment Outcomes of Weakly Positive Hormone Receptor Breast Cancer and Triple-Negative Breast Cancer
Article information
Trans Abstract
Purpose
In breast cancer, response to endocrine therapy depends on estrogen receptor and progesterone receptor status. However, poor prognosis is conferred on patients with hormone receptor (HR)-positive breast cancer. We aimed to examine weakly positive HR breast cancer by comparing weakly positive HR to strongly positive HR and negative HR breast cancer.
Methods
We examined the clinical and biological features of 1,496 women with breast cancer, and these patients were categorized according to HR status as weakly positive, strongly positive, and negative HR breast cancer.
Results
In this study, among 1,496 patients with breast cancer, negative HR breast cancer was found in 374, weakly positive HR breast cancer in 90 and strongly positive HR breast cancer in 1,032 patients. Our multivariate analysis showed that there were differences in T stage, tumor–node–metastasis stage, vascular invasion, histologic grade and type, and Ki-67 index. Patients with weakly positive HR breast cancer had an increased risk of death and recurrence compared with those with strongly positive HR breast cancer and had similar prognosis as patients with negative HR breast cancer.
Conclusion
Patients with weakly positive HR breast cancer received endocrine therapy because they were regarded as having positive HR breast cancer. However, their prognosis of overall survival and relapse-free survival was similar to that in patients with negative HR breast cancer. Therefore, we need to closely observe and consider active treatment for patients with weakly positive breast cancer.
서 론
유방암은 세계적으로 발생률이 증가하고 있으며 한국에서는 여성에게 발생하는 암 중 2위를 차지할 정도로 발생 빈도가 높은 암이다[1]. 암의 크기, 림프절 전이, 조직학적 분류, 조직학적 등급, 그리고 면역조직화학분석(Immunohistochemistry, IHC)에 의한 표지자인 에스트로겐 수용체(estrogen receptor, ER)와 프로게스테론 수용체(progesterone receptor, PR), 상피세포 성장인자 수용체 유형2 (human epidermal growth factor receptor 2, HER2) 등은 유방암의 예후와 예측인자로써 쓰이고 있다[2,3].
호르몬 수용체 음성 유방암은 호르몬 수용체 양성 유방암에 비해 예후가 좋지 않으며, HER2 음성 유방암에서 ER 또는 PR 단일 양성 유방암이 ER과 PR 모두 양성인 유방암에 비해 예후가 좋지 않은 것으로 보고되고 있다[4]. ER 양성 유방암은 실제 ER 발현 정도에 차이가 있어 ER 강양성 유방암, ER 약양성 유방암으로 나눌 수 있으며[5-7], 이러한 호르몬 수용체 발현 강도에 따라 호르몬 수용체 양성 유방암 환자군 내에서도 예후 및 치료 반응에 차이가 있을 것으로 생각하였다.
본 연구에서는 호르몬 수용체 양성 유방암 환자군 중에서 호르몬 수용체 약양성 유방암의 예후 및 특성을 살펴보기 위해 호르몬 수용체 강양성 유방암과 비교 분석을 시행하고, 나아가 호르몬 수용체 약양성 유방암 환자군이 삼중음성 유방암 환자군과 비교하여 치료 및 예후에 유의미한 차이가 있는지 알아보고자 하였다.
방 법
2009년 1월부터 2013년 12월까지 서울성모병원에서 유방암으로 수술받은 1,848명의 환자들을 대상으로 의무기록을 후향적으로 조사하였다. 대상 환자들의 나이, 유방 및 액와부 수술방법, 병기(조직검사결과로 병기 설정을 하였으며 수술 전 항암치료를 시행하였을 경우에는 임상적 병기 설정을 시행), 현미경적 림프관 또는 미세혈관 침윤 여부, 조직학적 유형 및 등급, ER, PR, HER2, Ki-67, 항암화학치료, 방사선치료 및 항호르몬 치료의 시행 여부를 비롯하여 수술 후 재발 여부 및 치료 결과를 포함한 장기생존 결과를 조사하였다. 수술 후 조직검사 결과가 유관상피내암(ductal carcinoma in situ, DCIS)으로 확인된 환자, 병기가 4기 유방암으로 확인된 환자, 경과 관찰이 중단된 환자는 분석에서 제외하여 최종 총 1,496명을 대상으로 분석하였다.
ER과 PR은 Allred 점수를 통해 양성 또는 음성으로 분류하였으며, 비율점수(proportion score, PS) (범위, 0–5점)와 강도점수(intensity score, IS) (범위, 0–3점)의 합으로 Allred 점수를 계산하였다[8]. 이전 연구들에서는 호르몬 수용체 약양성의 기준이 3점에서 4점 또는 3점에서 5점으로 제시되었다[5,9]. 비율점수가 2점인 호르몬 수용체 단일 양성 유방암에서 강도점수가 0점일 수 없고(1–2점), 따라서 Allred 점수는 3점에서 4점에 해당하므로 이에 따라 본 연구에서는 약양성의 기준을 3–4점으로 택하였다[10]. PR은 에스트로겐 조절 유전자(estrogen regulated gene)로, ER 약양성일 경우 PR의 역할이 크지 않다고 생각하여 PR과 상관없이 호르몬 수용체 약양성 군으로 분류하였으며, ER 강양성일 경우 PR과 상관없이 호르몬 수용체 강양성 군으로 분류하였다[11-13]. 면역조직화학분석은 VENTANA (Ventana Medical Systems Inc., Tucson, USA)를 이용하여 분석하였고 ER과 PR의 양성 판정은 미국임상종양학회/미국병리학회(American Society of Clinical Oncology/College of American Pathologists) 가이드라인을 따랐다.
통계는 IBM SPSS software version 20.0 (SPSS Inc., Chicago, USA) 프로그램을 이용하여 분석하였다. 연속 변수는 범위를 가진 중간값으로 표현하였고, 단변량 분석은 chi-square test 또는 Fisher’s exact test를 사용하였으며 다변량 분석은 cox-regression analysis를 사용하였다. 그리고 Kaplan-Meier analysis로 생존율을 산출하고 생존 곡선은 log-rank test로 비교하였다. 양측 검정을 이용하여 유의수준 0.05 미만(p<0.05)인 경우 의미 있는 차이가 있다고 판단하였다.
결 과
전체 환자 1,496명 중 호르몬 수용체 음성군 374명, 호르몬 수용체 약양성군 90명, 호르몬 수용체 강양성군은 1,032명으로 호르몬 수용체 발현 정도에 따른 각 군을 비교하여 보았을 때, TNM병기에서도 호르몬 수용체 강양성군은 1기의 비율이 높고 호르몬 수용체 약양성군과 호르몬 수용체 음성군은 2기와 3기의 비율이 높아 호르몬 수용체 발현 정도에 따른 유의한 차이가 있었다(p<0.001). 그리고 N병기의 등급은 세 군 간 유의한 차이가 없었으나(p=0.159), T병기의 등급이 세 군 간 유의한 차이가 있어(p=0.002) TNM병기에 따른 각 군의 차이는 T병기에 의한 것임을 확인할 수 있었다. 그리고 조직학적 등급에서도 각 군 간의 유의한 차이를 보였으며(p<0.001), 호르몬 수용체 음성군은 호르몬 수용체 강양성군에 비하여 고등급(3등급)의 비율이 62.6%로 높고, 호르몬 수용체 약양성군은 51.1%로 호르몬수용체 음성군과 비슷한 비율을 보였다. 그 외에도 각 군은 조직학적 유형, HER2, Ki-67에서 유의한 차이를 보였다(Table 1).
Cox-regression 모델을 이용하여 호르몬 수용체 발현 정도에 따른 전체 생존율에 대한 단변량 분석을 시행한 결과 T병기, N병기, 조직학적 등급(1, 2등급은 저등급, 3등급은 고등급으로 분류), HER2에 따라 유의한 차이를 보였다(Table 2). 그리고 이러한 요인들로 다변량 분석을 시행한 결과 호르몬 수용체 발현 정도에 따라 전체 생존율에 유의한 차이를 보였다. 이는 호르몬 수용체 발현 정도에 따른 전체 생존율에서 T병기, N병기, 조직학적 등급에서 유의한 결과를 보였으며 T병기, N병기 외에도 조직학적 등급도 좋지 못한 예후인자로서 기여한다는 것을 확인할 수 있었다.
무재발 생존율에 대한 단변량도 함께 시행하였으며, 호르몬 수용체 발현 정도에 따른 무재발 생존율은 유의한 차이를 보였으며, T병기, N병기, 조직학적 등급에서 유의한 결과를 보였다. 그리고 이러한 요인들로 다변량 분석을 시행하였으나 무재발 생존율에서는 호르몬 수용체 발현 정도에 따른 유의한 결과를 확인할 수 없었다.
생존율
호르몬 수용체 약양성의 기준을 Allred 점수 3점에서 4점으로 정하여 Kaplan-Meier 분석으로 생존율을 산출하였다(Figure 1). 호르몬 수용체 약양성군의 전체 생존율은 87.3%로 강양성군의 전체 생존율 97%와 비교 시 통계적으로 유의하게 낮았으며(p<0.001), 호르몬 수용체 음성군의 생존율 92.6%와 비교 시 전체 생존율은 낮았으나 두 군 간의 통계학적 유의성은 없었다(p=0.324).
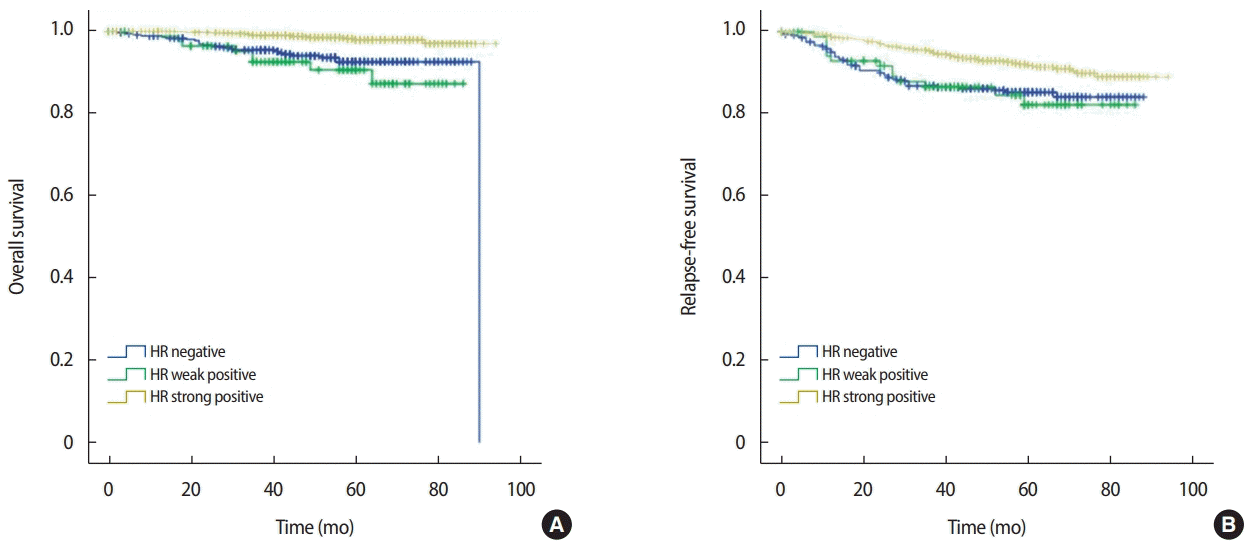
Kaplan–Meier survival curve according to the expression of HR status. (A) Overall survival and (B) relapse-free survival.
HR= hormone receptor.
호르몬 수용체 약양성군의 무재발 생존율은 82.2%로 호르몬 수용체 강양성군의 무재발 생존율 89%와 비교 시 유의한 차이를 보이는 것을 확인할 수 있었으나(p<0.001), 호르몬 수용체 음성군의 무재발 생존율 84.1%와 비교 시 유의한 차이를 보이지 않았다(p=0.831).
호르몬 수용체 약양성의 기준을 Allred 점수 3점에서 5점으로 하여 분석한 전체 생존율과 무재발 생존율에 대한 결과도 유사한 결과를 확인할 수 있었다(Figure 2). 호르몬 수용체 약양성군의 전체생존율은 90.9%로 강양성군의 전체 생존율 97%와 비교 시 통계적으로 유의하게 낮았으며(p<0.001), 호르몬 수용체 음성군의 생존율 92.6%와 비교 시 전체 생존율은 낮았으나 두 군 간의 통계학적 유의성은 없었다(p=0.910).

Kaplan–Meier survival curve according to the expression of HR status; the weak standard was a score of 3–5. (A) Overall survival and (B) relapse-free survival.
HR= hormone receptor.
호르몬 수용체 약양성군의 무재발 생존율은 84.5%로 호르몬 수용체 강양성군의 무재발 생존율 89%와 비교 시 유의한 차이를 보이는 것을 확인할 수 있었으나(p<0.001), 호르몬 수용체 음성군의 무재발 생존율 84.1%와 비교 시 유의한 차이를 보이지 않았다(p= 0.768). Allred 점수 5점에 해당하는 군이 약양성군에 해당됨에 따라 약양성군의 기준을 3점에서 4점으로 분석한 전체 생존율과 무재발 생존율에 비해 호르몬 수용체 약양성군의 예후가 좋아진 것을 확인할 수 있었다.
HER2 양성과 음성에 대해서도 분석을 진행하였으며 전체 생존율은 HER2 음성군 96%, HER2 양성군 92.7%로 전체 생존율은 두 군 간에 유의한 차이를 보이나(p<0.001), 무재발 생존율은 HER2 음성군 87.4%, HER2 양성군 87.3%로 유의한 차이를 보이지 않았다(p=0.195).
HER2 음성군을 대상으로 호르몬 수용체 약양성, 호르몬 수용체 강양성, 삼중음성군을 비교하였다(Figure 3). 호르몬 수용체 약양성군의 전체 생존율은 87.9%로 강양성군의 전체 생존율 97.3%와 비교 시 통계적으로 유의한 차이를 보였으며(p<0.001), 호르몬 수용체 음성군의 생존율 92.9%와 비교 시 두 군 간의 통계학적 유의성은 없었다(p=0.589).
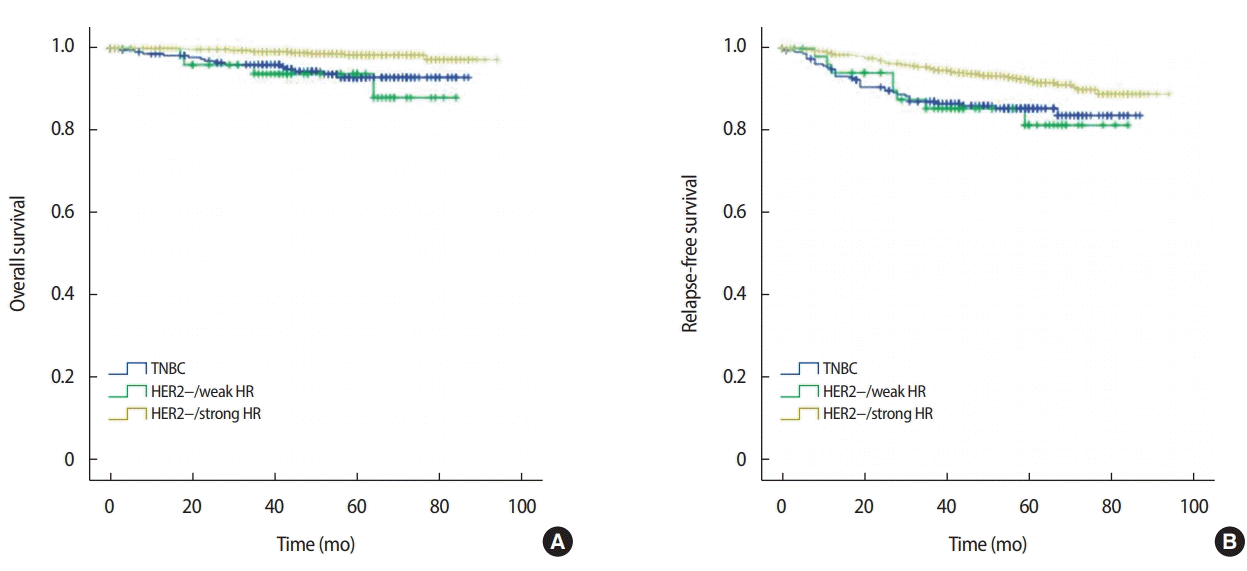
Kaplan–Meier survival curve according to the expression of HR status for negative HER2 breast cancer. (A) Overall survival and (B) relapse-free survival.
HR= hormone receptor; HER2= human epidermal growth factor receptor 2.
호르몬 수용체 약양성군의 무재발 생존율은 81.1%로 호르몬 수용체 강양성군의 무재발 생존율 88.8%와 비교 시 유의한 차이를 보이는 것을 확인할 수 있었으며(p<0.001), 호르몬 수용체 음성군의 무재발 생존율 83.5%와 비교 시 유의한 차이를 보이지 않았다(p=0.789).
고 찰
유방암은 내재성 분자 유형으로 luminal A/B, HER2 유전자 과발현, 기저양 유방암으로 분류되며[14,15] 모든 유방암의 mRNA를 RT-PCR을 통해 직접적으로 검사하는 것은 비용적으로 효율적이지 못하고 시간도 오래 소요되기 때문에, 이로부터 발현된 단백질을 이용하여 면역조직화학분석 기법을 통해 ER, PR, HER2 등에 대해 분석한다. 그리고 이를 통해 호르몬 치료 및 표적치료, 항암치료 등 치료방법을 결정하고 치료 반응 및 예후에 대한 예측을 하고 있다[16,17]. 실제로는 mRNA를 통한 유전자 검사와 면역조직화학분석 결과는 약 60%에서 70% 정도 유사함을 보이고, 특히 삼중음성유방암과 기저양 유방암을 비교해 보면 삼중음성유방암의 최대 75%정도가 기저 유전자 발현을 보인다[18]. 그리고 이들 중, 기저양 유방암에 해당되나 면역조직화학분석에 따른 표현형은 ER, PR 또는 HER2 양성을 보이는 유방암이 호르몬 수용체 약양성에 해당되어 타목시펜 등의 치료를 시행하였으나 그럼에도 예후가 좋지 못한 군일 가능성에 대해 주목하여 연구를 시행하였다.
실제 ER 약양성 유방암의 90%는 내강형에 해당하지 않으며, 이는 ER 약양성 유방암의 호르몬 치료의 이점에 대해 의구심을 들게 한다[9]. 따라서 ER 약양성 유방암의 경우 기저양유방암의 분자유전학적 특성에 해당되는 것이 다수로, 이로 인해 호르몬 수용체 음성 군과 예후가 비슷할 것이라는 가설을 세우고 이에 대해 비교를 하였다.
그리고 호르몬 수용체 약양성 유방암의 기준은 일반적으로 3점에서 4점 또는 3점에서 5점으로 고려하며, 본 연구에서는 3점에서 4점을 기준으로 잡았다. 이는 5점을 약양성에 해당시킬 경우 비율점수는 4점이면서 강도점수는 1점인 유방암도 호르몬 수용체 약양성으로 보아야 하는데 강도만 떨어질 경우 염색 등 기술적인 문제의 오류일 가능성도 배제하기 어려울 수 있기 때문이다[10].
본 연구 결과에서 ER과 PR의 영향력에 따라 새로 분류하게 된 그룹에서 호르몬 수용체 약양성에 해당되는 경우, 전체 생존율 및 무재발 생존율이 호르몬 수용체 음성 유방암에 가까운 결과가 도출되었다. 이는 본 연구의 가설처럼 실제로 호르몬 수용체 약양성 유방암의 경우 호르몬 수용체는 양성을 보이나 기저양 유방암에 해당되어 좋지 못한 예후를 보일 가능성을 시사한다. 이러한 군에 대해 최종적으로 유전학적 검사를 시행하여 확인하였다면 이 가설에 대해 충분히 입증 가능하였을 것으로 보이나 후향적 연구로서, 시행되었던 치료 및 예후에 대해서만 조사하고 분석하였기 때문에 이에 대한 제한점이 있겠다.
본 연구의 최종적 목표는 호르몬 수용체 약양성의 경우 양성으로 분류되어 치료를 시행하고 있으나 무재발 생존율 및 전체 생존율의 양상이 호르몬 수용체 음성과 비슷하므로 호르몬치료를 하더라도 치료 예후에 대해 보다 집중적인 경과 관찰 및 다른 치료방법을 적극적으로 시행해야 한다는 것이다. 최근 삼중음성유방암의 치료에 대해 androgen receptor에 대해서도 표적치료법에 대한 논의가 되고 있으며[19,20] 호르몬 수용체 약양성 유방암의 경우도 함께 이에 대한 고려를 할 수 있겠다. 또한 최근 재발성 또는 전이된 호르몬 수용체 양성 유방암에 대해 palbociclip 투여가 보험적용이 되어 많이 이용되고 있는데[21,22] 재발이나 전이가 발생하지 않더라도 약양성에 이를 적용하는 것에 대해서도 고려를 하여 볼 수 있겠다.
본 연구의 제한점은 첫째, 대상 환자 수가 충분하지 않아 HER2 음성과 양성에 대해 추가하지 못한 부분이 있어 삼중음성유방암과의 정확한 비교를 하지 못한 것이다. 추후 후속 연구에서는 대상 환자 수를 추가하여 HER2 양성과 음성에 대한 부분 또한 포함하여 연구할 계획이다. 두 번째는 폐경에 따른 분석을 추가하지 못한 것이며, 이는 50세를 기준으로 분석하여 보완하려 하였으나 결과적으로 유의하지 못한 결과가 검출되었다. 이 역시 후속 연구에서는 폐경에 대한 분석도 추가할 예정이다.
Notes
The authors declare that they have no competing interests.

