한국 여성에서 신체질량지수와 유방암 발생과의 관련성에 대한 연구
Analysis of the Relationship between Body Mass Index and Breast Cancer Incidence in Korean Women
Article information
Trans Abstract
Purpose
Obesity in women has been shown to have correlation with breast cancer incidence. The proportion of Korean women who are obese has increased recently. However, there is no large-scale study evaluating the relationship between obesity and breast cancer incidence in Korea. In this study, we tried to identify the relationship between obesity and breast cancer incidence in Korean women by using body mass index (BMI)
Methods
A retrospective analysis was performed using single-center data of 28,631 patients screened with breast ultrasonography or mammography between January 2009 to December 2013 in Seoul National University Hospital Healthcare System Gangnam Center. Their clinical characteristics were evaluated. The correlations between breast cancer incidence with BMI and other factors were analyzed using univariate and multivariate logistic regression models.
Results
A total of 28,631 patients were enrolled; 67 patients were diagnosed with breast cancer. Among patients without breast cancer, the proportion of patients with BMI under 23 was 68.1%, whereas it was 56.7% among patients with breast cancer (p=0.036). In univariate analysis, patients with a BMI over 25 had an odds ratio of 2.09 for breast cancer compared with those with a BMI under 23 (p=0.012). In addition, patients with a waist circumference over 85 cm had an odds ratio of 1.69 for breast cancer compared with the others (p=0.042). In multivariate analysis, BMI also had significant correlation with breast cancer incidence (odds ratio=1.87, p=0.035).
Conclusion
An increase in BMI has positive correlation with breast cancer incidence in Korean women. However, a multi-centered prospective study is needed for further evaluation.
서 론
전세계적으로 유방암은 높은 발생률을 보이고 있으며 동시에 높은 5년 생존율을 보이고 있다. 전 세계적으로 유방암은 암 중 발생률 11.9%, 사망률 6.4%, 5년 생존율은 87%이다[1]. 한국인 여성에서도 유방암은 암 중 발생률 7.4%, 유병률 19.2% (2012년 기준)의 높은 수치를 보이고 있으며 그 발병률이 점진적으로 증가하고 있어 유방암의 임상적 중요성은 강조되고 있다[2].
국가별 지역별로 차이는 있으나 미국, 일본 등에서 연구된 바에 의하면 신체질량지수(body mass index, BMI) 증가는 유방암 발생과 관련성이 있으며 예후 또한 신체질량지수가 높을수록 좋지 않은 것으로 보고되고 있다[3-5]. 비만과 유방암 발생과의 연관성을 설명하는 가설로는 에스트로겐 혈중 농도가 높을수록 호르몬에 반응하는 호르몬수용체양성 유방암의 발생이 증가하는데, 체지방의 증가는 여성호르몬 분비의 합성 작용을 통해 에스트로겐 혈중 농도를 높이며 이는 결과적으로 유방암 발생의 위험도를 높이게 되는 것으로 알려져 있다[6].
최근의 국내 여성의 비만인구 비율은 신체질량지수 25.0을 기준으로 하였을 때 2008년에서 2012년 사이에 25.2%에서 28.0%로 2.8% 상승하였고 지속적인 증가 추세를 보이고 있다[2]. 따라서 한국인 여성에서 관찰되는 비만인구의 증가가 유방암의 발생과 어떠한 상관관계를 가지는 지 분석하는 것은 임상적으로 중요한 문제로 인식되고 있으나 국내에서 비만과 유방암 발생과의 연관성에 대한 연구는 많지 않다. 본 연구에서는 단일기관에서 진행된 국내 검진데이터를 이용하여 한국인 여성에서 비만정도와 유방암의 발생위험을 단면연구를 통해 분석해보고자 한다.
방 법
대상자 선정
2009년 1월부터 2013년 12월까지 서울대학교병원강남센터에서 유방초음파, 유방촬영술을 포함한 건강검진을 받은 환자 중 연구 조건에 해당되는 자료를 확보할 수 있는 28,631명을 대상으로 하였다. 후향적연구로 서울대학교병원강남센터 전산시스템 ‘BESTCARE’ 및 PACS system을 이용하여 Institutional Review Board (IRB) 승인 하(IRB 승인 number: 1407-065-595)에 차트 및 자료 검색을 진행하였다.
조사 인자
전체 대상자에서 조직 검사가 필요한 대상자 신체질량지수, 대사증후군 여부, 허리둘레, 중성지방수치, 고밀도지질단백질수치, 혈압, 혈당수치, 유방암 여부를 조사하였고 대상자들을 폐경 전후로 나누어 각 인자의 유방암 발생과 관련성을 확인하였다.
분석 방법
분석 기간 동안 건강 검진을 받은 환자 중, 유방초음파 또는 유방촬영술을 시행한 대상자를 우선 선정하였다. 이 중에 조사 인자에서 언급한 신체질량지수, 대사증후군 여부, 허리둘레, 중성지방수치, 고밀도지질단백질수치, 혈압, 혈당수치를 파악할 수 있는 대상자를 선별하였다. 선별된 대상자는 28,631명으로 유방초음파 및 유발촬영술에서 Breast Imaging-Reporting and Data System 4 (BI-RADS 4) 이상의 등급을 받은 경우 조직 검사 결과에서 유방암이 진단되었는지 여부를 확인하였다. 유방암은 유관 상피내암(ductal carcinoma in situ), 소엽 상피내암(lobular carcinoma in situ), 침윤성 유관암(invasive ductal carcinoma), 침윤성 소엽암(invasive lobular carcinoma) 및 기타 암종을 포함하였다. 각 조사 인자 별로 유방암 발생과 관련성이 있는지 단변량 분석을 통하여 분석하였고, 단변량 분석에서 유의수준 0.2에서 유의했던 요인들을 보정 요인으로 고려하여 다변량 분석을 진행하였다. 각 분석은 대상자들을 폐경 전후 집단을 나누어 각 집단에 따라 조사 인자와 유방암 발생의 관련성에 차이가 있는지 분석을 진행하였다.
통계분석
분석 프로그램으로 SAS version 9.2 (SAS Institute Inc., Cary, USA)과 R (version 3.1.2)을 사용하였다. 대상자 특성 기술 분석은 빈도 및 분율로 요약하였고, 카이제곱검정(chi-square test)은 피셔직접확률법(Fisher’s exact test)을 이용하여 그룹 간 비교하였다. 단변량 분석은 로지스틱회귀기법을 이용하여 알아보았다. 다변량 분석은 변수 선택법(Stepwise)을 이용하여 유방암 발생에 유의한 영향을 주는 보정요인을 선택하였다(entry level: 0.05, stay level: 0.05). 선택된 요인들을 보정한 후 다중로지스틱회귀기법을 이용하여 알아보았다. 대상자 특성 기술 분석, 단변량 분석, 다변량 분석은 모두 폐경 전후로 그룹을 나누어 분석하였다.
결 과
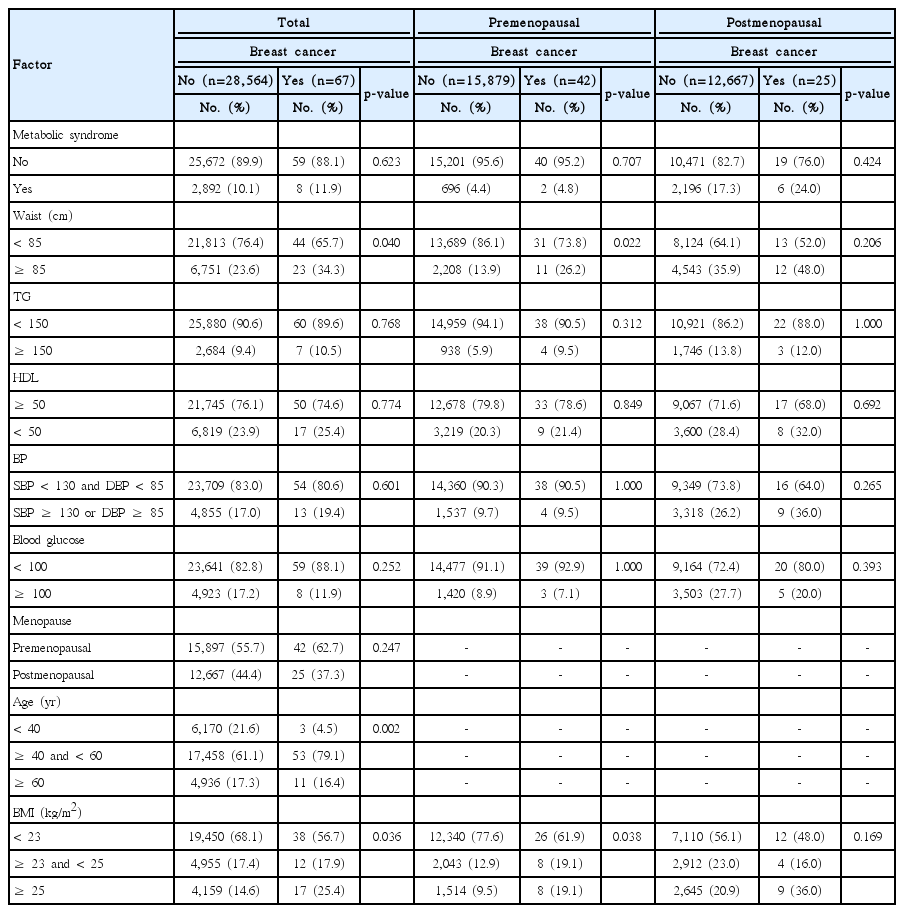
전체 연구대상 28,631명 중 BI-RADS 4 이상으로 조직검사를 받은 대상자는 1,602명(5.6%)이었고 이 중 유방암으로 진단된 대상자는 67명(0.2%)이었다. 신체질량지수의 경우 유방암으로 진단되지 않은 대조군과 비교하여 유방암으로 진단된 군에서 과체중의 비율이 유의하게 높았다(p=0.036, Table 1). 허리둘레의 경우 역시 유방암군에서 허리둘레가 85 cm 이상인 경우가 유의하게 높았다(p=0.040). 허리둘레와 신체질량지수가 유방암의 발생여부와 가지는 통계적 연관성은 폐경 전 여성에서 더욱 유의하게 관찰되었으며, 폐경 후 여성에서는 신체질량지수는 비슷한 양상을 보였으나 통계적으로 유의하지 않았으며 허리둘레는 차이를 보이지 않았다(Table 1). 이를 유방암 발생 위험도로 환산하였을 때 신체질량지수 25 이상의 경우 유방암 위험도가 전체여성에서 2.09배 증가하였으며(unadjusted OR 2.09 [1.18-3.71], p=0.012) 폐경 전 여성에서는 2.51배(unadjusted OR 2.51 [1.13-5.55], p=0.023), 폐경 후 여성에서는 2.02배(unadjusted OR 2.02 [0.85-4.79], p=0.112) 증가하였다(Table 2). 혈중 콜레스테롤 수치, 고혈압 여부, 대사증후군 여부 등 기타 만성질환과 유방암의 위험도와는 유의한 연관성을 보이지 않았다(Table 2).
단변량분석에서 신체질량지수와 허리둘레 이외에도 유의한 것으로 확인된 나이를 보정하여 다중로지스틱회귀분석을 이용한 다변량분석을 시행하였다(Table 3). 다변량분석에서 나이와 신체질량지수는 유방암 위험도와 유의한 연관성을 보였으나 허리둘레는 유의한 독립변수가 아니었다. 나이를 보정한 후에도 신체질량지수 25 이상인 과체중 여성에서 유방암의 위험도가 1.87배 증가하는 것을 확인하였으며(adjusted OR 1.87 [1.05-3.36], p=0.035), 이 현상은 폐경전 여성과 폐경 후 여성에서 비슷한 위험도로 관찰되었다. 그러나 폐경을 기준으로 소그룹으로 나눠 시행한 분석에서는 경계적 유의성이 관찰되었다(Table 3).
고 찰
본 연구에서 단변량 분석의 결과 전체 대상자에서 신체질량지수 증가, 허리둘레 증가, 나이의 증가는 유방암의 발생 증가와 관련성이 있는 것으로 확인되었다. 폐경 전에도 동일한 관련성을 보였으나, 폐경 후에는 신체질량지수, 허리둘레, 나이의 증가와 유방암의 발생과는 유의한 관련성이 없었다. 다변량 분석의 결과 전체 대상자에서 나이를 보정하였을 때 신체질량지수의 증가는 유방암 발생의 위험을 높이는 것으로 확인되었으나 폐경을 기준으로 구분하였을 때 폐경 전 그룹에서 신체질량지수가 높을 때 유방암 발생률이 높았지만 유의한 정도는 아니었다.
통상 비만도가 높은 여성인 경우 유방암의 발생 위험이 높은 것으로 알려져 있다. Neuhouser 등[7]과 Morimoto 등[8]에 의해 미국에서 이뤄진 연구에 의하면 폐경 후 여성에서 신체질량지수가 높은 경우 유방암의 발생의 위험도가 높은 것으로 확인되었다. 이에 반해 비만의 정도와 유방암의 상관 관계가 명확하지 않거나 관련성이 유의하지 않은 연구 결과도 존재한다. Kann 등[9]에 의하면 스위스 여성에서는 비만도가 높은 여성의 비율이 높지 않아 신체질량지수와 유방암의 상관관계를 분석하는 데 한계가 있었다. 또한, 핀란드에서 Song 등[10]에 의해 시행된 연구에 의하면 신체질량지수와 유방암의 발생은 역상관관계에 있는 것으로 보고되었다. 서구 여성에서는 비만도와 유방암 발병과의 연관관계가 보고된 경우에도 폐경 후 여성에서만 그 연관성이 확인되었고, 폐경 전 여성에서는 반대로 유방암의 위험도를 감소시킬 수도 있음이 다수의 연구에서 보고된 바 있다[11].
그러나 Wada 등[12]은 일본에서 인구기반코호트연구(population based cohort study)를 통해 폐경 후 뿐만이 아니라 폐경 전의 여성에서도 신체질량지수가 증가하면 유방암 발생빈도가 높은 것을 확인하였다. 본 연구에서도 우리나라 여성은 전체 대상자에서는 신체질량지수와 유방암 위험도에 양의 상관관계가 있는 것으로 확인되었고, 폐경 전에서도 신체질량지수가 증가할수록 유방암의 위험도가 증가하는 경향을 보였다. Wada 등[12]은 폐경 전의 여성이 신체질량지수 30 이상의 고도 비만일 경우 무배란증으로 인한 혈중 에스트로겐 수치 감소로 유방암 발생 위험이 감소할 수 있다고 설명하고 있다. 그러나 Wada 등의 연구에서와 유사하게 한국 여성은 서양 연구 대상자들과 다르게 신체질량지수 30 이상의 고도 비만이 많지 않았고, 결과적으로 폐경 전 무배란증에 의한 효과가 미미하여 폐경 전 한국 여성에서 신체질량지수의 증가는 유방암 발생의 위험을 높인 것으로 생각된다. 이러한 결과들을 종합해 보았을 때 대부분의 연구 결과는 신체질량지수와 유방암 발생이 양의 상관관계가 있다고 생각할 수 있으나 지역별, 국가별로 세부적인 내용에 차이가 존재함을 알 수 있다. 이는 인종, 지역에 따른 인구집단의 비만도 정도, 생활 습관, 흡연력, 초경/폐경 시기 등의 요인에 의하여 발생하는 것으로 생각된다[13].
본 연구는 후향적 연구로 연구 대상자의 수가 적고 한국 여성 전체를 대상으로 한 인구기반연구가 아닌 단일기관연구로, 건강 검진을 받기 위해 단일센터에 내원한 대상자를 연구하였기에 이에 의한 한계점이 존재한다. 유방암과 호르몬 수용체와의 상관관계 및 이와 비만도의 관계가 외국의 논문에서 다뤄지고 있다. 그러나 본 연구에서 분자 생물학적인 자료의 불충분함으로 인하여 신체질량지수와 호르몬 수용체의 양성 여부, 그리고 신체질량지수와의 상관관계를 연구하는 것에도 한계가 있었다. 또한 대상자 수의 불충분함으로 인하여 유방암 세부 종류별로 분석을 시행하는데 한계가 있었다. 국내에는 고도 비만 여성의 수가 적어 비만인 대상자에서 유방암의 수가 적다는 점도 한계로 생각된다. 그러나 우리나라 여성의 비만도가 증가하고 있고 기존에 여성의 신체질량지수와 유방암 발생의 관계에 대한 연구가 드물었다는 점은 본 연구가 갖는 의의라고 생각한다[14].
결론적으로 한국 여성에서 유방암 발생률은 신체질량지수와 상관관계가 있는 것으로 확인되었고 신체질량지수 조절은 유방암의 발생 위험을 낮출 수 있을 것이라고 생각된다. 신체질량지수 증가와 호르몬 수용체 발현 정도 및 이에 따른 유방암의 증가 여부 등에 대한 추가 연구를 통해 신체질량지수 증가가 유방암을 높이는 원인에 대한 연구가 필요할 것으로 생각된다. 본 연구는 파일럿 연구의 의미를 가지며 향후 대규모 대상자를 기반으로 한 연구가 필요할 것으로 생각된다.
Notes
The authors declare that they have no competing interests.
Acknowledgements
This work was supported by the Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Education, Science and Technology (2015 R1D1A1A02061904), by the grant from the National R&D Program for Cancer Control, Ministry for Health and Welfare, Republic of Korea (A1520250), and by the grant of the Korea Health Industry Development Institute (KHIDI), funded by the Ministry of Health & Welfare, Republic of Korea (HI14C1277 and HI13C2148).