원격전이가 발생한 폐경전 여성 유방암 환자에서의 예후인자
Prognostic Factors for Premenopausal Women with Distant Metastatic Breast Cancer
Article information
Trans Abstract
Purpose
Several studies have reported that the survival after distant metastasis in younger patients with breast cancer was similar to that in elderly patients. Moreover, few studies have observed better survival outcome after distant metastasis in younger patients with breast cancer. Here, we have identified the factors that affect the prognosis after distant metastasis in these patients.
Methods
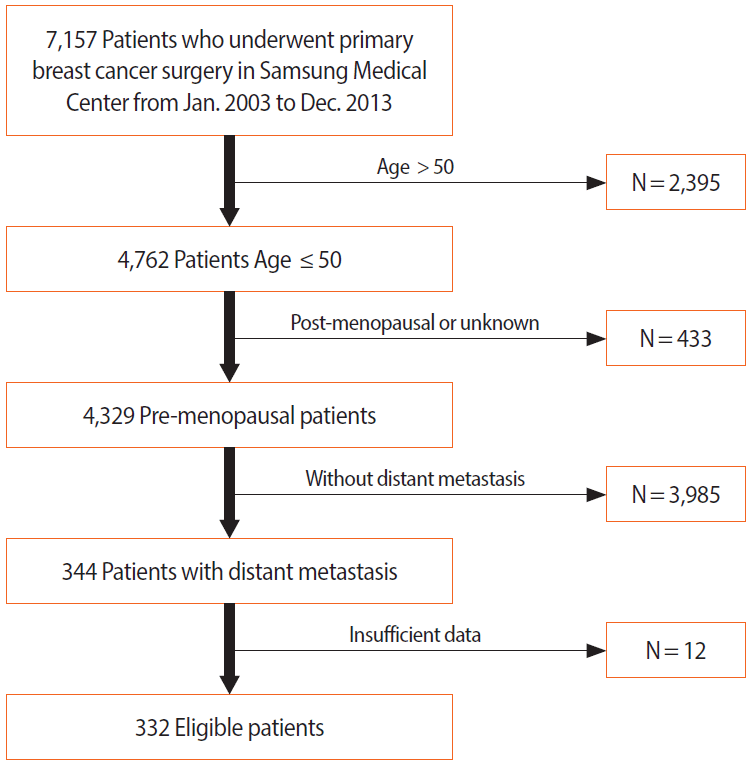
We reviewed 7,157 patients that underwent primary breast cancer surgery between January 2003 and December 2013 at the Samsung Medical Center. Three hundred and thirty two premenopausal patients aged <50 years showed distant metastasis and were included in the analysis. For further analysis, the patients older or younger than 40 years were divided into 2 groups.
Results
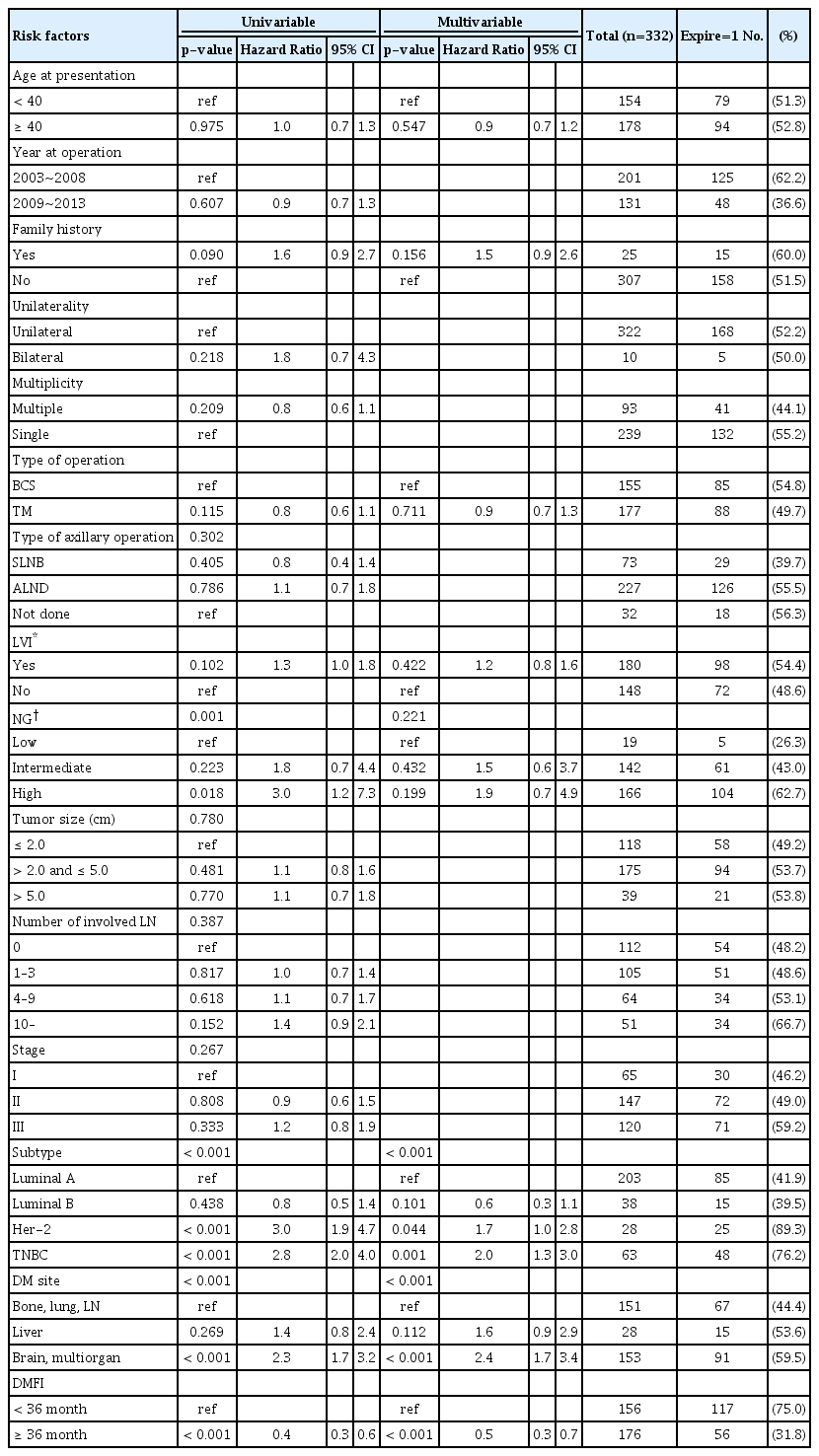
There were no demographic differences in the patient characteristics such as clinical stage, nuclear grade, lymphovascular invasion, distant metastasis site, distant metastasis free interval (DMFI), except the estrogen receptor (ER) and progesterone receptor (PR) statuses, histopathology, and molecular subtype in both the groups (p-value=0.023, 0.035, 0.016, 0.046, respectively). The median follow-up period was 79.4 months. Next, we did not observe significant difference in the overall survival (OS) between the two groups (Log rank p-value=0.975). However, patients in the luminal A and luminal B group showed better OS than those in human epidermal growth factor receptor-2 (HER-2) positive, and triple-negative breast cancer (TNBC) group (Log-rank p-value<0.001). Furthermore, patients showed worse OS when they developed distant metastases within 36 months post-surgery (Log-rank p-value<0.001). In overall, age did not affect the survival outcome (p-value=0.547); however, the molecular subtype, DMFI, and distant metastasis sites showed significant differences in the patient outcome (p-value<0.001, respectively).
Conclusion
Our analysis suggests that the molecular subtype, DMFI, and distant metastasis site serve as useful predictors for prognosis in younger breast cancer patients with distant metastasis. However, age in these patients did not correlate well with mortality.
서 론
아시아 국가들의 유방암 발생률은 지속적으로 증가하고 있으며, 한국 중앙 암 등록 본부(Korea central cancer registry)의 2016년도 통계에 따르면 유방암은 유병자 수 314,610명으로 갑상선 암을 제치고 여성들에게서 가장 많은 암으로 확인되었으며, 2016년에 21,747건의 새로운 사례가 발생하였다[1].
또한 아시아 국가에서는 폐경 전의 젊은 유방암 환자가 많은 것으로도 알려져 있다[2,3]. 젊은 연령대에서 발생한 유방암은 고령의 환자에서 발병한 경우에 비해 공격적인 생물학적 행동을 보이고, 보다 적극적으로 치료해도 재발률이 높고 사망 위험도가 높은 나쁜 예후를 보인다[4-8].
그러나, 유방암으로부터 원격 전이가 발생한 환자들에서 초기 진단 당시의 나이가 예후에 미치는 영향은 여전히 논란이 되고 있다[9-12]. 뿐만 아니라 원격 전이된 젊은 유방암 환자의 예후에 관한 연구자체가 거의 없었다. 이에 이 연구는 초기 유방암 진단 당시 연령이 50세 이전인 환자들 중 원격 전이가 발생한 환자들에게 나이가 예후에 미치는 영향을 검증하고, 그 이외에는 어떠한 다른 예후인자들이 있는지 알아내고자 시행되었다.
방 법
환자 선정
2003년 1월부터 2013년 12월까지 처음 진단 당시 원격 전이가 없는 7,157명의 유방암 환자가 삼성서울병원에서 수술적 치료를 받았다. 이 환자들에서 원격 전이의 발생여부와 전이 후 경과를 확인하기 위해 환자의 의무 기록을 검토했다. 첫 진단 당시 폐경 상태가 아닌 50세 미만의 환자를 조사한 결과, 4,329명의 환자 중 추적 관찰 기간 동안 344명의 환자에게서 원격 전이가 확인되었다. 의무기록에서 분석에 필요한 정보가 누락된 12명의 환자가 연구에서 제외 되었다.
자료 수집
초기 진단 시 원격 전이가 보이지 않았던 환자들은 수술 후 정기적인 추적 관찰을 6개월마다 총 5년간 시행하였고, 그 이후로는 1년 간격으로 시행하였다. 매 방문마다 환자들은 국소 재발 혹은 원격 전이 여부 확인을 위하여 영상 검사와 혈액 검사를 포함한 의료진의 진료를 받았다. 국소 재발을 확인하기 위해 유방 초음파 검사와 유방 X선 검사가 포함된 영상 검사를 6개월마다 시행하였고, 원격 전이 감시를 위해 매년 흉부, 복부 및 골반의 전산화 단층 촬영(CT) 검사와 전신 골주사 검사(bone scan)를 시행하였다.
환자의 의무 기록을 통해서 진단 당시 나이, 유방암 가족력, 수술 날짜, 수술 방법, 병리학적 병기, 에스트로겐 수용체(estrogen receptor, ER)/프로게스테론 수용체(progesterone receptor, PR)/인간 표피성장인자 수용체 2 (human epidermal growth factor receptor-2, HER-2) 여부, 원격전이 진단일, 원격전이 장소 등의 자료를 얻었고, 호르몬 수용체 여부에 따라 유방암을 4가지의 아형으로 분리하였다: luminal A (ER 양성 그리고/혹은 PR 양성, HER-2 음성), luminal B (ER 양성 그리고/혹은 PR 양성, HER-2 양성), HER-2 (ER, PR 음성, HER-2 양성), 삼중음성(triple negative breast cancer, TNBC) (ER, PR, HER-2 모두 음성)[13].
이 연구에서 우리는 환자가 처음 원격 전이가 발견되었을 당시의 전이 부위만을 고려하였는데 이는 단일 전이이거나 다발성 전이이기도 하였다. 고립되어 발생한 동측 혹은 반대측 유방에서의 재발, 국소 림프절 또는 국소 흉벽에서의 재발이 있는 경우는 원격 전이에 포함하지 않았다. 전이 부위는 뼈, 뇌, 간, 폐/흉막, 원격 림프절 및 다중 부위 전이로 분류되었다.
원발성 유방암의 수술적 치료 이후 첫 원격전이 진단까지의 기간을 distant metastasis-free interval (DMFI)으로 정의했다. 전이 후 생존기간(post-metastasis overall survival, PMOS)은 최초 전이 진단일에서부터 사망일 혹은 최근 추적 관찰일까지로 계산하였다. 사망 관련 정보에 대해서는 한국 통계청 및 삼성서울병원의 의무기록을 통하여 확인하였다.
통계 방법
잠재 위험 요소들과 이 연구에서 보고자 하는 결과인 PMOS와의 연관성을 Cox 비례 위험 회귀 분석법을 통해 분석하였다. 단변수 분석에서 p 값이 0.200 미만인 요인들을 다변수 분석에 포함시켰다. 임상적으로 중요한 ‛진단 당시 연령’은 단변수 분석에서 p 값과 상관없이 다변수 분석에 포함되었다. 그리고 주요 위험인자에 대하여 Log rank test를 통하여 생존 곡선을 얻어내었다. 모든 통계 분석은 SAS 버전 9.4 (SAS Institute Inc, Cary, NC, USA)를 사용하여 수행되었다. p 값이 0.050 미만인 경우에 통계적 유의성을 갖는 것으로 생각하였다.
윤리 사항
이 연구는 헬싱키 선언의 윤리 규정을 준수하여 수행되었으며, 삼성서울병원의 윤리위원회에 의해 검토 및 승인되었다(IRB No. 2019-07-012-002). 이 연구를 통해 연구 대상자에게 미칠 위험성이 낮아 이 연구에 포함된 환자들에게 고지된 동의를 받는 과정은 생략되었다.
결 과
환자 특성
해당 기간에 수술받은 환자 중 초기 진단 당시 50세 미만의 폐경 전 여성이면서 이후 원격전이가 발생한 환자 총 332명이 연구에 포함되었다(Figure 1). 이들 중 40세 미만의 환자가 154명(46.4%), 40세 이상의 환자가 178명(53.6%)였다. Table 1에서 40세 이상 환자 군과 40세 미만 환자 군의 임상 병리학적 특성을 비교하였다. 임상 병기, 핵 등급, 림프 혈관 침윤 여부, 원격 전이 위치, DMFI는 두 군 간에서 인구학적 차이를 보이지 않았다. ER 음성인 101명의 환자 중에 64명 (63.4%)이 40세 이상이었고, ER 양성인 231명의 환자 중에는 114명(49.3%)이 40세 이상으로, ER 음성 환자에게서 유의하게 40세 이상이 비율이 높았다(p=0.023). 마찬가지로 PR 음성 환자에서 PR 양성 환자보다 40세 이상의 비율이 높았다(p=0.035). 분자 아형을 비교하였을 때, luminal A 환자의 48.3%가 40세 이상이었으며, 삼중음성 환자에서는 68.3%가 40세 이상으로, 다른 분자 아형 환자보다 삼중음성 환자에서 40세 이상인 환자의 비율이 유의하게 높았다(p=0.006).
단변수 위험도 분석
Cox 비례 위험 회귀 분석을 통한 결과 중 단변수 위험도 분석에서는 다양한 요인들이 PMOS와 유의한 상관관계를 보였다. 핵 등급이 높은 환자 군이 낮은 환자 군에 비해 사망률이 높았다(HR=3.0, 95% CI 1.2-7.3, p=0.018). 분자 아형 간 비교하였을 때 HER-2 양성 환자 군과 TNBC 환자 군이 luminal A 환자 군에 비해 사망률이 더 높았다(HR=3.0, 95% CI 1.9-4.7, p<0.001/HR=2.8, 95% CI 2.0-4.0, p<0.001). 그리고 뇌 전이 혹은 다장기 전이가 있을 때 뼈, 폐, 원격 림프절 전이가 있을 때보다 사망 위험도가 높은 것도 나타났다(HR=2.3, 95% CI 1.7-3.2, p<0.001). 36개월 이후에 원격 전이가 발생한 경우 그 이전에 전이가 일어났을 때보다 사망률이 낮은 것으로 나타났다(HR=0.4, 95% CI 0.3-0.6, p<0.001) (Table 2).
다변수 위험도 분석
임상적으로 중요한 지표인 ‘진단 당시 나이’를 포함하여 단변수 분석에서 p 값이 0.200 미만이었던 요인들로 다변수 분석을 실시하였고, 그 결과 분자 아형, 원격 전이 장소, DMFI 세 개의 변수에서만 유의한 결과값을 나타내었다(Table 2).
생존 곡선
연구에 포함된 전체 환자 군의 평균 PMOS 기간은 36.4(표준편차±30.7)개월이었다. 추적관찰 기간의 중앙값은 79.4(범위 13.5-178.2)개월이었다. 로그 순위법을 통해 생존곡선을 구한 결과, 40세 전후의 환자 군에서 생존율은 유의한 차이를 보이지 않았다(로그 순위 p=0.975) (Figure 2A). 반면에 분자 아형에 따라 분석 결과 luminal A, luminal B에 비해 HER-2, TNBC 환자 군에서 유의하게 생존율이 낮게 나타났다(로그 순위 p<0.001) (Figure 2B). 또한 DMFI 36개월을 기준으로 나눈 두 그룹에서도 36개월 미만인 그룹에서 유의하게 낮은 생존율을 보이고 있다(로그 순위 p<0.001) (Figure 2C).
고 찰
이 후향적 연구는 한국인 환자들의 자료를 통해, 첫 진단 당시에 50세 미만인 젊은 폐경 전 유방암 환자들에서 원격전이 이후의 예후에 영향을 미치는 요인에 대해 밝히고 있다. 결론적으로 50세 미만의 환자에서는 진단 당시의 나이가 전이 이후의 전체 생존 기간에 유의한 차이를 나타내지 못하였다. 대신에 원발암의 분자 아형, 원격 전이 장소, 수술 후 원격 전이 발견까지의 기간이 전이 후 전체 생존 기간에 유의한 차이를 유발하는 중요한 예측인자로 나타났다.
일반적으로 유방암에서 젊은 나이는 나쁜 예후, 더욱 공격적인 생물학적 특성과 상관관계가 있다고 생각되어왔다[14-17]. 하지만 몇몇 연구에서 전이성 유방암에서는 나이라는 요인이 생존기간과 큰 연관성이 없다고 주장하였다[11,18]. Tjokrowidjaja 등은 40세를 기준으로 하여 나이에 따른 유방암의 전이성 재발의 위험도와 재발 후의 예후를 비교한 논문을 통해 전이성 유방암 환자들의 중앙 생존기간이 40세 미만의 여성들과 그 이상 연령의 여성들에서 각각 18개월과 14개월로 큰 차이를 보이지 않았다고 보고했다(로그 순위 p=0.21) [18]. 심지어 Largiler 등의 연구에서는 304명의 50세 미만 전이성 유방암 환자보다 734명의 50세 이상 전이성 유방암 환자의 사망 위험도가 더 높은 것으로 나타났다(HR=1.44, 95% CI 1.15-1.79, p=0.001) [19]. 반면에 Xiong 등 [10] 은 전이성 유방암 환자의 생존 모델을 설립하는 연구에서 초기 진단 연령 35세 이상, 50세 미만의 유방암 환자들이 35세 미만의 환자들보다 사망위험도가 낮은 것으로 보고했다(HR=0.53, 95% CI 0.31-0.91, p=0.020). 우리 연구는 이전의 연구들과는 다르게 초기 진단 당시 50세 미만의 젊은 유방암 환자들을 대상으로 시행한 연구이며, 40세를 기준으로 비교하였을 때 50세 미만의 전이성 유방암 환자에서는 초기 진단 당시 나이가 사망률에 유의한 영향을 미치지 않는다는 연구 결과를 보이고 있다. 이는 20대 혹은 30대 유방암 환자들에서 원격전이가 발견되었을 때 흔히 젊은 나이일 수록 경과가 더 안 좋을 것이라는 부정적인 심리적 부담감을 덜어줄 수 있는 결과라고 생각된다.
이전의 연구들은 전이성 유방암에서 DMFI, 원격전이 장소, 호르몬 수용체 여부가 독립적인 예후인자임을 보여주었다[10,11,19-21]. Kim 등 [22] 의 논문에서 DMFI를 2년, 5년을 기준으로 세 그룹으로 분류하였을 때 유의한 생존율의 차이를 보인다고 보고하였고(로그 순위 p<0.001), 그뿐만 아니라 연속형 자료로서도 유의하게 예후와 연관되어 있다고 보고하였다(HR=0.96, CI 0.96-0.97, p<0.001). 우리 연구는 수술일로부터 3년 이후에 원격전이를 진단받은 환자들이 3년 이내에 원격전이가 진단된 환자들에 비하여 생존율이 유의하게 높게 나타나고 있어 앞선 연구들과 일치하는 결론을 내고 있으며, 50세 미만의 젊은 유방암 환자들에서도 DMFI가 전이 후 생존에 중요한 예후인자임을 알 수 있다.
전이성 유방암의 유방암 아형에 따른 생존율 차이를 비교한 이전의 연구들에 따르면 호르몬 수용체 음성/HER-2 수용체 음성인 경우가 가장 생존율이 좋지 않고, 호르몬 수용체 양성/HER-2 수용체 양성인 경우가 생존율이 가장 좋다고 알려져 있다[23-25]. 삼중음성 유형의 유방암은 이번 연구에서도 마찬가지로 좋지 않은 예후를 보이고 있었지만, HER-2 유형도 luminal A, luminal B형에 비해서 좋지 않은 예후를 보인다는 점과 luminal A형과 luminal B형은 예후에 유의한 차이를 보이고 있지 않다는 점이 이전의 연구들과 다른 결과를 보이고 있다. 이는 호르몬 수용체가 양성인 경우는 음성인 경우에 비해 더 좋은 예후를 보이고, HER2 수용체의 여부는 생존율에 유의한 차이를 보이지 못했다는 다른 연구들[10,11]의 결론과 일맥상통한 결과를 보이는 것으로 생각된다.
이 연구는 몇 가지의 제한점을 가지고 있다. 우선 이 연구는 후향적이고 단일 기관에서 시행된 연구로, 선택 편향을 가지고 있고, 분석에 포함된 환자수가 적다. 또한 이 연구는 초기 진단 당시 전이 소견 없이 수술 받은 이후에 원격 전이가 발생한 재발성 환자들을 대상으로 한 연구로, de novo metastatic breast cancer 환자에 대한 연구는 포함되지 않아 이들을 포함한 추가적인 연구가 필요하다고 생각한다.
진행성 유방암에서는 overall survival (OS)이 일반적으로 환자의 예후에 대한 지표로 사용되지만 최근 전이성 유방암에서 OS의 대체 지표로서 progression free survival (PFS)이 사용되며, OS에 비하여 치료의 임상적 효과를 더 민감하게 반영한다는 보고들이 있다[26]. 우리 연구에서 예후 지표로 설정한 PMOS는 breast subtype과 최신 치료법에 영향을 많이 받아 후향적 연구에서 의미가 크지 않다는 제한점이 있다. 하지만 PFS에 대하여 통계를 시행하였을 때 PMOS와 같은 양상으로 subtype, DMFI에 의해 PFS에 유의한 차이가 나타남을 알 수 있다(Supplementary Figure 1).
이 연구는 한국인들을 대상으로 시행한 연구로, 연구 대상의 인종적 단일성이라는 장점을 가지고 있으며, 단일 기관 연구였기 때문에 대상자들의 임상/병리적인 자세한 내용들에 대한 자료를 포함하고 있다는 장점이 있다. 또한 상대적으로 한국에서 젊은 나이의 유방암 환자의 비율이 높았기 때문에 단일기관에서 시행된 연구 중에 비교적 많은 수의 50세 미만 전이성 유방암 환자를 포함하였다는 점도 이 연구의 강점이다.
결론적으로, 젊은 나이의 유방암은 일반적으로 안 좋은 예후로 알려져 있지만, 젊은 나이에서 원격 전이가 발생한 환자에서는 진단 당시의 나이가 예후에 영향을 미치지 않고, 나이보다는 원격 전이 장소, 분자 아형, 수술 이후 원격 전이가 발생하기까지의 기간이 예후 인자로서 중요성을 갖는다.
Supplementary Materials
Kaplan–Meier curve for progression free survival based on the age at presentation (A), molecular subtype (B), and distant metastasis free interval (DMFI) (C).
Notes
The authors declare that they have no competing interests.