유방의 유두종 환자에서 초음파 유도하 맘모톰흡입생검의 유용성 및 안전성
Feasibility and Safety of Ultrasound-Guided Vacuum-Assisted Breast Biopsy System for Intraductal Papilloma
Article information
Trans Abstract
Purpose:
We aimed to evaluate the feasibility and safety of ultrasound-guided vacuum-assisted breast biopsy system for the treatment of intraductal papilloma (IDP). A vacuum-assisted breast biopsy system mammotome® was recently introduced for simultaneous biopsy and excision of benign breast masses. Mammotome excision has the advantages of safety and less scar formation compared to open biopsy. Wide excision is a standard treatment for IDP of the breast.
Methods:
We retrospectively reviewed the clinical data by using the electric medical records of 752 cases of breast masses that were treated via Mammotome excision performed by a single surgeon between January 2007 and December 2012. Among these patients, 26 patients were diagnosed with benign IDP as indicated in the final pathologic reports.
Results:
The median follow-up period was 56.2 months (range, 29–92 months). Two patients were diagnosed with another IDP during the follow-up period. However, no recurrence was detected at the previous excision site, but new primary lesions were confirmed at another quadrant.
Conclusion:
We suggest that ultrasound-guided vacuum-assisted breast biopsy system may be feasible and safe for the treatment of IDP.
서 론
유방의 양성 종괴에 대한 고식적인 치료방법은 절개를 통한 종괴 절제술이다. 그러나 유방의 양성 질환을 수술하는 데 있어 미용적 측면을 고려해 수술 상처를 최소화 하거나 유방조직의 최소 절제를 시행하는 등의 많은 시도들이 있어왔으며 맘모톰흡입생검(ultrasound-guided vacuum-assisted biopsy system)을 통한 종괴의 절제도 그 중 하나로 시행되고 있다.
유방의 이상은 일반적으로 유방촬영술과 초음파를 통해 발견된다. 이렇게 발견된 종괴는 Breast Imaging Reporting and Data System(BI-RADS) 분류에 의하여 category 4a 이상인 경우 조직검사를 시행하고, 그 중 양성으로 진단된 경우 선택적으로 맘모톰을 이용한 절제술을시행한다[1].
관내 유두종(intraductal papilloma)은 전체 여성의 2%–3% 정도에서 발생하는 것으로 보고된다[2]. 유방에서 발생하는 유두상 병변(papillary lesion)은 양성인 관내 유두종(intraductal papilloma)부터 이형성(atypia) 또는 상피내 암종(carcinoma in situ)을 동반한 유두종(papilloma), 유두상 증식양상을 보이는 관상피내암(ductal carcinoma in situ) 및 유두상 선암종(papillary adenocarcinoma)에 이르기까지 다양한 형태로 나타나는 질환을 일컫는다[3]. 최근까지 조직검사에서 관내 유두종으로 진단된 경우 절개를 통해 종괴가 있는 유관을 포함한 완전 절제를 시행하는 것이 표준 술식으로 시행되어 왔다. 하지만 시행된 많은 연구들에서 이러한 관내 유두종의 경우 맘모톰을 이용한 절제만으로도 치료가 가능하다는 것이 보고된다[4].
이에 유방의 관내 유두종에 대한 치료로 고식적인 절개를 통한 종괴 절제술을 대신하여 맘모톰 절제술이 적절한지 알아보고자 본 연구를 시행하였다.
방 법
2007년 1월부터 2012년 12월까지 조선대학교병원에서 1명의 외과의사에 의해 시행된 맘모톰흡입생검(Mammotome Hand Held; Johnson & Johnson, Cincinati, USA)을 통한 절제술을 시행 받은 752명의 환자에 대해 후향적으로 조사를 시행하였다. 전체 752명의 병리결과를 확인하여 이 중 최종 조직검사 결과 관내 유두종으로 진단된 26명의 환자를 본 연구의 대상으로 하였다. 대상 환자들의 의무기록을 토대로 분석하여 수술 전 영상의학적 진단, 초음파를 이용해 측정한 종괴의 크기, 수술 후 병리학적 진단, 추적검사 기간, 합병증, 재발 유무 등을 조사하였다.
맘모톰 절제술을 시행하기 전 모든 환자는 초음파를 시행하였고, 이 초음파 결과를 바탕으로 맘모톰 절제술 시행 여부를 결정하였다. 맘모톰 절제술은 생리식염수와 1:1로 혼합된 리도카인을 이용하여 국소마취를 한 뒤 8-게이지 맘모톰 바늘을 이용하여 종괴의 아래 부분에 바늘을 위치시키고 종괴를 포함하여 종괴 주변의 정상조직 일부를 포함한 절제를 시행하였다. 맘모톰 절제술을 통해 얻은 조직은 파라핀 블록을 한 뒤 4–5 µm 두께로 잘라 슬라이드를 만든 후 병리검사를 통해서 진단했다. 맘모톰 절제술 후 추적검사는 초음파를 통해 수술 후 첫 1년은 6개월 간격으로, 그 후부터는 1년 간격으로 시행하였다. 본 연구는 조선대학교병원 Institutional Review Board (승인번호: 2015-08-014) 승인 하에 시행되었다.
결 과
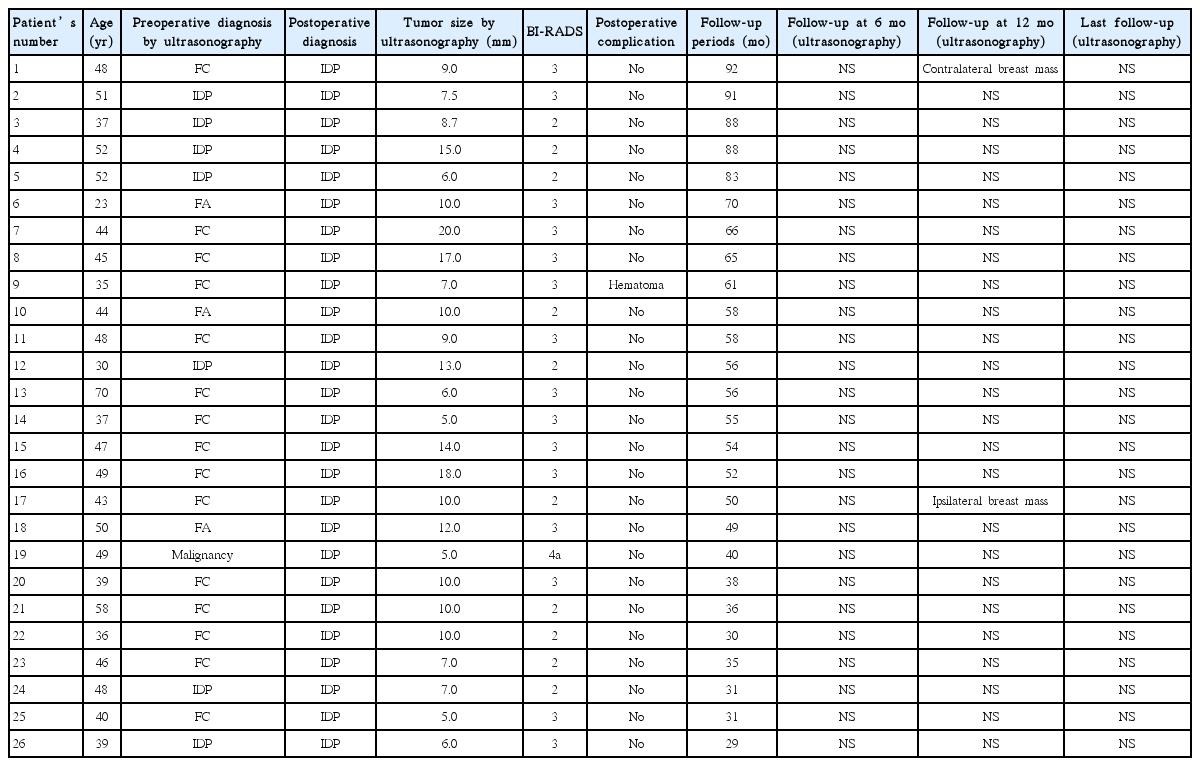
환자의 평균 나이는 44.6±9.2세(범위, 23–70세)였으며, 수술 전 초음파로 측정한 종괴의 평균 크기는 10±5 mm (범위, 5–20 mm)였다.
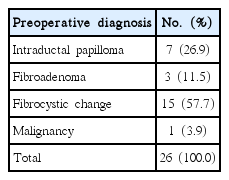
본 연구에 포함된 26명의 환자들 중에서 수술 전에 시행한 초음파 결과 관내 유두종으로 진단된 경우는 7명(26.9%), 섬유선종으로 진단된 경우는 3명(11.5%), 섬유낭성 변화로 진단된 경우는 15명(57.7%), 악성으로 의심되는 경우는 1명(3.9%)이었다(Table 1).
대상 환자의 평균 추적관찰 기간은 56.2±19.8개월(범위, 29–92개월)이었으며, 모든 환자에 대해 초음파를 이용한 추적관찰을 시행하였다(Table 2). 맘모톰 절제술 후 합병증이 발생한 환자는 1명으로 절제술 직후 절제 부위에 혈종이 발생하였으나 탄력붕대를 이용한 압박으로 추가적인 수술 없이 해결되었다. 추적관찰 기간 동안 2명의 환자에서 관내 유두종이 새로 발생하였는데, 1명은 맘모톰 절제술 1년 후에 반대측 유방에, 다른 한 명은 동측 유방의 다른 사분면에 관내 유두종이 발생하였다. 두 명 모두에서 추가적으로 맘모톰 절제술을 시행하였으며 이후 추적관찰 기간 동안 재발 등의 특이소견 없음을 확인하였다.
고 찰
유방에 발생하는 양성 질환에 대해 수술을 시행하는 경우 미용적인 측면을 고려해 수술 후 발생하는 반흔을 최소화 하고자 여러 방법들이 시도되어 왔다. 이러한 시도들 중 맘모톰 절제술은 반흔은 최소화 하면서 진단과 동시에 완전 절제를 한번에 시행할 수 있는 방법으로 널리 시행되고 있다.
유방의 종괴에 대한 진단 방법으로 중심생검(core needle biopsy)이 보편적으로 시행되고 있다. 그러나 기존의 연구에 따르면 중심생검의 경우 병변의 일부만을 채취하는 방법으로 제한된 정보만을 제공한다는 한계가 보고된다[5-8]. 이에 비해 맘모톰 절제술은 병변의 전체를 절제하는 방법으로 병변 전체에 대한 정보를 제공할 수 있다는 장점이 있으며 기존의 연구에서 높은 진단의 정확도가 보고되었다[9]. 본 연구에 포함된 전체 26명의 환자에서도 검체의 불충분한 채취로 인해 진단이 어려웠던 사례는 없었으며 이를 비추어 볼 때 맘모톰 절제술은 진단의 정확도 측면에서 높은 진단적 가치를 보이고 있다.
유방의 병변에 대한 접근은 일차적으로 이학적 검사와 더불어 유방촬영술과 필요한 경우 유방 초음파를 통해서 이루어진다. 이런 영상의학적 검사 결과를 바탕으로 유방의 종괴는 필요한 경우 세침흡입검사나 중심생검을 통해 조직검사를 시행하고 그 결과를 바탕으로 경과관찰을 하거나 절제술을 시행하게 된다. Sydnor 등[10]은 관내 유두종으로 진단된 경우에는 추가적인 수술적 치료 없이 추적관찰로 충분하다고 보고하였으며, Agoff와 Lawton [11]도 중심생검을 통해 진단된 양성 질환에 대해 추가적인 수술적 절제 없이 평균 35.6개월간의 추적관찰을 시행한 결과 악성으로 전환된 경우는 없었다고 보고하였다. Philpotts 등[12]은 중심생검을 통해 양성으로 확인된 6예에 대해 수술적 절제 없이 추적관찰이 가능했고 영상의학적 소견과 조직검사 소견이 불일치할 경우만 수술적 절제가 필요하다고 주장하였다. 이러한 측면에서 맘모톰 절제술은 유방에 발생하는 양성 질환의 진단과 동시에 절제술을 시행할 수 있는 장점을 가지고 있다.
초음파 검사에서 BI-RADS category 2, 3, 4에 해당되는 크기 30.0 mm 미만의 양성 종양을 맘모톰 절제술 시행 이후 92.8%의 환자에서 6개월 뒤 초음파를 이용한 추적관찰에서 절제 부위에서 추가적인 병변이 관찰되지 않아 완전 절제를 보였다는 결과와[13], BIRADS category 3에 해당되는 30.0 mm 이상의 양성 종양 25예 중 88%에서 6개월 뒤 초음파를 이용한 추적관찰에서 완전 절제를 보였다는 결과도 보고 되었다[14]. 본 연구에서도 30.0 mm 미만의 관내 유두종에서 평균 56.2±19.8개월의 추적관찰 기간 동안 절제 부위에서의 추가 병변 등의 재발을 시사하는 소견은 단 한 건도 없었으며, 이러한 결과를 바탕으로 맘모톰 절제술이 관내 유두종의 치료로써 적합함을 확인할 수 있었다.
맘모톰 절제술 후 발생할 수 있는 합병증은 1.3%–9.0%로 이 중 가장 흔한 합병증은 수술 부위의 혈종으로 보고되어 왔다[15-17]. 본 연구에서도 합병증은 26명 중 1명(3.8%)에서 발생한 혈종으로 기존의 보고와 비슷한 수준의 비율을 보였으며 맘모톰 절제술의 안전성을 반영하는 결과로 생각된다.
결론적으로 본 연구를 통해 맘모톰 절제술이 관내 유두종의 진단의 정확도와 치료의 안전성에 있어 고식적인 치료를 대체할 수 있을 것이라고 생각된다. 다만 본 연구의 한계점으로 많지 않은 환자를 대상으로 시행한 후향적 연구인 만큼 추후 많은 수의 환자를 대상으로 전향적인 연구가 시행되어야 할 것이다.
Notes
The authors declare that they have no competing interests.